Fórmula esqueletal
En química orgánica, la fórmula esqueletal de un compuesto orgánico es una representación abreviada de su estructura molecular. Las fórmulas esqueletales son ubicuas en química orgánica, debido a que muestran estructuras complicadas de una forma clara, y son rápidas y sencillas de dibujar. Los compuestos orgánicos se pueden clasificar de acuerdo al tipo molecular
Esqueleto de carbono
[editar]El término "esqueletal" se refiere al esqueleto de carbono de un compuesto orgánico —esto es, las cadenas, ramas y/o anillos de átomos de carbono que forman la base de la estructura de una molécula orgánica—. El esqueleto puede tener otros átomos o grupos de átomos, unidos a sus átomos de carbono. El hidrógeno es el átomo diferente de carbono más común, que está enlazado a un átomo de carbono, y no se le dibuja explícitamente. Otros átomos son conocidos como heteroátomos, y los grupos definidos de átomos se denominan grupos funcionales, puesto que le dan una función a la molécula. Los heteroátomos o grupos funcionales son conocidos colectivamente como sustituyentes, puesto que se consideran como sustitutos del átomo de hidrógeno que estaría presente en el hidrocarburo padre del compuesto orgánico en cuestión.
Átomos de hidrógeno y carbono implícitos
[editar]Por ejemplo, en la imagen inferior, se muestra la fórmula esqueletal del hexano. El átomo de carbono etiquetado como C1 tiene sólo un enlace mostrado, así que debe haber tres átomos de hidrógeno enlazados a él, con el fin de hacer que el número total de enlaces sea cuatro (ver regla del octeto). El átomo de carbono etiquetado como C3 tiene dos enlaces a otros átomos de carbono, y en consecuencia está enlazado a dos átomos de hidrógeno. Con fines comparativos, se muestra un modelo de barras y esferas de la estructura molecular real del hexano, según como es determinada por una cristalografía de rayos X, en el que los átomos de carbono están representados por bolas negras, y los átomos de hidrógeno por bolas blancas.

Representación de bolas y barras del hexano, con los átomos de carbono (negro) e hidrógeno (blanco) mostrados explícitamente.
Cualquier átomo de hidrógeno enlazado a átomos diferentes del carbono se muestran explícitamente. En el etanol, C2H5OH, por ejemplo, el átomo de hidrógeno unido al átomo de oxígeno se muestra directamente. Las líneas que representan enlaces heteroátomo-hidrógeno se suelen omitir por claridad y compactación, así que un grupo hidroxilo frecuentemente es escrito como −OH, en vez de −O−H. Algunas veces, estos enlaces son dibujados totalmente, con el fin de acentuar su presencia cuando participan en mecanismos de reacción.
Para comparación, se muestra abajo un modelo de barras y bolas de la estructura tridimensional real de la molécula de etanol en la fase gaseosa (determinada por espectroscopia de microondas, izquierda), la estructura de Lewis (medio) y la fórmula esqueletal (derecha).


Heteroátomos explícitos
[editar]Todos los átomos que no son carbono o hidrógeno se les representa por su símbolo químico, por ejemplo, Cl para el cloro, O para el oxígeno, y Na para el sodio. Estos átomos son heteroátomos conocidos comúnmente en el contexto de la química orgánica.
Símbolos de pseudoelementos
[editar]También hay símbolos que parecen ser símbolos químicos elementales, pero representan sustituyentes muy comunes o indican un miembro no específico de un grupo de elementos. Estos son conocidos como símbolos de pseudoelementos, o elementos orgánicos.[1] El símbolo más ampliamente usado es Ph, que representa al grupo fenilo. A continuación se muestra una lista de pseudoelementos:
Elementos
[editar]- X para cualquier átomo de halógeno
- D para un átomo de deuterio
- M para cualquier átomo metálico
- T para un átomo de tritio
Grupos alquilo
[editar]- R para cualquier grupo alquilo, o incluso para cualquier sustituyente
- Me para el grupo metilo
- Et para el grupo etilo
- n-Pr para el grupo propilo
- i-Pr para el grupo isopropilo
- Bu para el grupo butilo
- i-Bu para el grupo isobutilo
- s-Bu para el grupo butilo secundario
- t-Bu para el grupo butilo terciario
- Pn para el grupo pentilo
- Hx para el grupo hexilo
- Hp para el grupo heptilo
- Cy para el grupo ciclohexilo
Sustituyentes aromáticos
[editar]- Ar para cualquier sustituyente aromático
- Bn para el grupo bencilo
- Bz para el grupo benzoílo
- Mes para el grupo mesitilo
- Ph para el grupo fenilo
- Tol para el grupo tolil
- Cp para el grupo ciclopentadienilo
- Cp* para el grupo pentametilciclopentadienilo
Grupos funcionales
[editar]- Ac para el grupo acetilo (Ac es también el símbolo para el elemento actinio. Sin embargo, en química orgánica casi nunca se encuentra al actinio, así que el uso de Ac para representar al grupo acetilo nunca causa confusión)
Grupos salientes
[editar]Enlaces múltiples
[editar]Dos átomos pueden estar enlazados al compartir más de un par de electrones. Los enlaces comunes al átomo de carbono pueden ser enlaces simples, dobles, o triples. Los enlaces simples son los más comunes, y son representados por una sola línea sólida entre dos átomos en una fórmula estructural. Los enlaces dobles son denotados por dos líneas sólidas paralelas, y los enlaces triples por tres líneas paralelas.
En teorías de enlace más avanzadas, existen valores no enteros de órdenes de enlace. En estos casos, una combinación de líneas sólidas y entrecortadas indican la parte entera y no entera del orden de enlace, respectivamente.
-
El hex-3-eno tiene un enlace doble carbono-carbono interno -
El hex-1-eno tiene un enlace doble terminal -
El hex-3-ino tiene un enlace triple carbono-carbono interno -
El hex-1-ino tiene un enlace triple carbono-carbono terminal
N.B. en la galería de arriba, los enlaces dobles están representados en rojo, y los enlaces triples en azul. Esto fue agregado por claridad - normalmente los enlaces múltiples no se colorean en fórmulas esqueletales.
Anillos de benceno
[editar]
Anillo de benceno con círculo
Los anillos de benceno son muy comunes en compuestos orgánicos. Para representar la deslocalización de los electrones en los seis átomos de carbono del anillo, se dibuja un círculo en el interior del hexágono de enlaces simples. Este estilo es muy común en libros de textos introductorios de química orgánica usados en escuelas.

Estructura de Kekulé del benceno
Un estilo alternativo que es más común a nivel académico es la estructura de Kekulé. Aunque puede ser considerado inexacto puesto que implica tres enlaces simples y tres enlaces dobles (el benceno sería entonces 1,3,5-ciclohexatrieno), todos los químicos calificados son plenamente conscientes de la deslocalización en el benceno. Las estructuras de Kekulé son muy útiles para dibujar mecanismos de reacción claramente.
Estereoquímica
[editar]La estereoquímica se denota convenientemente en fórmulas esqueletales:[2]
- las líneas sólidas representan enlaces en el plano del papel o pantalla
- las cuñas representan enlaces que apuntan hacia afuera del plano del papel o pantalla, acercándose al observador
- las líneas punteadas representan enlaces que apuntan hacia afuera del plano del papel o pantalla, alejándose del observador
- las líneas ondeadas representan, o bien una estereoquímica desconocida, o una mezcla racémica de dos enantiómeros posibles
-
2-cloro-2-fluoropentano -
Fórmula esqueletal estereoquímica del (R)-2-cloro-2-fluoropentano, uno de los dos enantiómeros posibles -
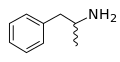
Fórmula esqueletal de la anfetamina, mostrando su naturaleza racémica
Las fórmulas estructurales pueden representar isómeros cis y trans de alquenos. Se pueden utilizar enlaces simples o cruzados para representar estereoquímica desconocida o no especificada de una mezcla de isómeros.
Enlaces de hidrógeno
[editar]Algunas veces, los enlaces de hidrógeno son denotados por líneas punteadas o entrecortadas.
Enlaces externos
[editar]- Drawing organic molecules de chemguide.co.uk
Referencias
[editar]- ↑ Plantilla:Clayden
- ↑ J. Brecher (2006). «Graphical representation of stereochemical configuration (IUPAC Recommendations 2006)». Pure Appl. Chem. 78 (10): 1897-1970. doi:10.1351/pac200678101897.